PERIODO 4 : PROCESOS
CIENCIA TECNOLOGÍA Y SOCIEDAD
INDICADORES DE DESEMPEÑO
- Diferencia y caracteriza las propiedades y estados de la materia.
- Diferencia y caracteriza los métodos de separación de mezclas.
- Reconoce la estructura del átomo y las características de los principales modelos atómicos .
- Identifica y clasifica los elementos químicos de acuerdo a sus propiedades y número atómico.
- Identifica los postulados que explican la evolución del modelo atómico.
- Explica los tipos de enlace en los elementos y los relaciona con la electronegatividad.
ESTÁNDARES
- Establezco relaciones entre características microscópicas de la materia y las propiedades físicas y químicas de las sustancias químicas
- Explico el desarrollo de modelos de organización de los elementos químicos.
- Explico y utilizo la tabla periódica como herramienta para predecir procesos químicos.
- Indago sobre un avance tecnológico en medicina y explico el uso de las ciencias naturales en su desarrollo.
- Me informo para participar en debates sobre temas de interés general en ciencias.
TEMAS
- Composición de la materia
- El átomo y su estructura
- La tabla periódica
- Enlace químico
SUBTEMAS
- Propiedades de la materia
- Repaso y nivelación grado sexto
- El átomo y partículas subatómicas.
- Postulados de los Modelos atómicos.
- Visión moderna del átomo.
- Propiedades de los átomos:Número y Masa atómica
- Configuración electrónica.
- La tabla periódica y su organización.
- Clasificación y propiedades generales de los elementos de la tabla periódica.
- Enlaces químicos y tipos de enlaces químicos
METODOLOGÍA DE EVALUACIÓN
La evaluación será continua e integral buscando el
mejoramiento y apropiación de los saberes en los estudiantes para identificar
sus falencias y plantear nuevas alternativas y estrategias de aprendizaje; para
ello se tendrá en cuenta los siguiente porcentajes:
70% Seguimiento individual
- Exposiciones
- Experimentos caseros
- Explicaciones de los temas
- Construcción de mapas conceptuales
- Actividades de clase para afianzar los temas
- Evaluaciones
- Talleres
- Consultas y sustentación
- Análisis de vídeos
25% Bimestral
5% Autoevaluación y
coevaluación
BIBLIOGRAFÍA Y
CIBERGRAFÍA
- ARBELAEZ E, Fernando. Contextos Naturales 7. Bogotá. Editorial Santillana. 2004
- PEÑA BORRERO, Luis Bernardo. Ciencias Naturales 7°. Editorial Santillana.
- MORA Beavista-Galdys Carmenza Hipertexto Ciencias 7 Ed.Santillana
- www. cienciaredcreativa.org/enlaces.htm
- www.buenastareas.com
- www.elrincondelvago.com
ACTIVIDADES



ACTIVIDAD N° 1 Sobre composición de la materia
1.Observa el siguiente vídeo y presenta un informe escrito sobre su contenido
2. Observa y lee detenidamente el siguiente mapa conceptual y escribe ejemplos de cada una de las propiedades que allí se presentan.

3.Encuentra las palabras y luego busca el significado de cada una

ACTIVIDAD N° 2 Sobre estructura atómica y modelos atómicos
1. Realizar una presentación de los principales modelos atómicos y sus aportes a la química en diapositivas por medio del programa Power Point. Debes poner ideas claras e imágenes .
Este trabajo debes enviarlo al correo isabelzpt2@gmail.com
2.Lee cuidadosamente los términos que aparecen a continuación y has un pequeño resumen de lo que entendiste, además investiga que otros estados de la materia podemos encontrar aparte de los tres mas comunes LIQUIDO, SOLIDO Y GASEOSO.
Materia es todo aquello que ocupa un lugar en el espacio, se encuentra en constante movimiento y transformación mediante fenómenos físicos yquímicos, principalmente. Su existencia es independiente de nuestros sentidos y el hombre.
El hombre estudia la materia según la forma como se manifiesta:
1. Forma condensada (materia condensada según Albert Einstein), sustancia o cuerpo material, posee dos características imprescindibles: masa y volumen(extensión), como los ejemplos citados: A, B y C
2. Forma dispersada (materia dispersada según Albert Einstein), o simplemente Energía, como los ejemplos citados en D.
¿Que es la masa de un cuerpo material?
La masa, es la cantidad de materia o cantidad de partículas (átomos, iones o moléculas) que posee un cuerpo y se mide en unidades de: gramo, kilogramo, libra, tonelada, etc.
La masa inercial, es la medida de la resistencia que ofrece a cambiar su estado de reposo o movimiento, llamado inercia. Por ejemplo, una bola de plomo ofrece mayor resistencia que un balón de futbol, para ponerlos en movimiento. Por lo tanto la bola de plomo tiene mayor masa (mayor inercia).
¿Qué es Energía?
La energía es una forma o cualidad intangible de la materia que causa un cambio o interacción de cuerpos materiales, en otros términos es la capacidad para realizar trabajo.
La energía puede ser mecánica (cinética y potencial), calorífica, luminosa, eléctrica, nuclear, electromagnética (ondas de TV, radio, microondas, rayos x, etc.)
Relación Masa – Energía
Albert Einstein en 1905, en su obra “Teoría Especial de la Relatividad”, plantea que la masa y energía son dos formas de la materia que están relacionados, mediante la siguiente expresión:

ACTIVIDAD N° 3 sobre tabla periódica
1. Practica las siguientes actividades
2.Escoja la respuesta correcta
a. El tercer período de la Tabla Periódica está formado por los elementos Na, Mg, Al, Si, P, S, Cl y Ar ¿Cuál de ellos posee menor tamaño?:
El sodio
El argón
El cloro
No puede predecirse
b. En el grupo de los halógenos, formado por los elementos F, Cl, Br, I y At ¿Cuál de ellos posee mayor electronegatividad?:
El flúor
El astato
El iodo
No puede predecirse
3. Señala las afirmaciones correctas:
a.Los elementos Li y Na tienen propiedades químicas parecidas por estar en el mismo grupo
b. Los elementos Mg, Al, P y S tienen propiedades parecidas por estar en el mismo período
c. Los elementos con carácter metálico tienen tendencia a formar iones negativos
d. Los no-metales tienen tendencia a ganar electrones
4.Completa el siguiente texto :
En la Tabla Periódica actual, los elementos químicos conocidos aparecen colocados por orden creciente de su número____________ en 7 filas horizontales, llamadas ______________y 18 columnas, llamadas ____________, cuyos elementos tienen un comportamiento químico ______________.
5.Completa el siguiente cuadro teniendo en cuenta los
elementos químicos correspondientes a los siguientes números atómicos:1,25,37,56,118,75,64,7,11,17
símbolo
|
nombre
|
e-
|
P+
|
n
|
Z
|
A
|
ACTIVIDAD N° 4 sobre modelos atómicos
1.Los átomos de un mismo elemento químico tienen todos en su núcleo el mismo número de .
2. Un átomo tiene 12 protones, 13 neutrones y 12 electrones. ¿Cuál es su número atómico?
12
13
24
25
3. Los isótopos oxígeno-16, oxígeno-17 y oxígeno-18, se diferencian en:
a. El número de protones
b. El número atómico
c. El número de neutrones
d. El número de electrones
4. Un átomo de volframio (W) tiene 74 protones y 108 neutrones. ¿Cuál es su representación adecuada?
1. 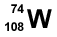 2.
2. 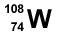 3.
3. 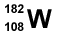 4.
4. 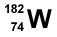
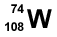 2.
2. 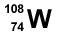 3.
3. 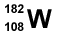 4.
4. 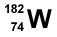
5. Señala las afirmaciones correctas:
a. El número másico de un átomo es la suma del número de protones, neutrones y electrones
b. Todos los átomos de un mismo elemento químico tienen el mismo número de neutrones
c. Los isotopos de un elemento químico tienen el mismo número atómico
d. Los isotopos de un elemento químico tienen el mismo número másico
e. Los isotopos de un elemento químico tienen distinto número de neutrones
ACTIVIDAD N° 5 sobre configuración
electrónica
1.¿Cuántos electrones poseen los átomos de argón (Ar), de número atómico 18, en su capa o nivel de energía más externo?:
2 electrones
6 electrones
8 electrones
18 electrones
2. ¿Cuál de las siguientes configuraciones electrónicas corresponde al átomo de cobre (Cu), de número atómico 29? (En la notación se indican los niveles por números colocados como coeficientes y los índices de las letras indican el número de electrones en ese subnivel):
a. 1s2 2s2 2p6 3s2 3p6 3d10 4p1
b. 1s2 2s2 2p6 3s2 3p6 3d10 4s2
c. 1s2 2s2 2p6 3s2 3p6 3d10 4s1
d. 1s2 2s2 2p6 3s2 3p6 4s10 4p2
3. ¿Qué tienen en común las configuraciones electrónicas de los átomos de Li, Na, K y Rb?:
a. Que poseen un solo electrón en su capa o nivel más externo
b. Que poseen el mismo número de capas o niveles ocupados por electrones
c. Que tienen completo el subnivel s más externo
d. Sus configuraciones electrónicas son muy diferentes y no tienen nada en común
4. ¿Qué tienen en común las configuraciones electrónicas de los átomos de Ca, Cr, Fe, Cu y Zn? Señala las afirmaciones correctas:
a. Todos tienen el mismo número de capas o niveles ocupados por electrones
b. Tienen el mismo número de orbitales ocupados por electrones
c. Todos tienen el mismo número de electrones en su nivel más externo
d.Tienen pocos electrones en su nivel más externo
